La bioproduction, correspondant à la phase de fabrication de médicaments biologiques innovants, est un domaine en pleine expansion, essentiel pour répondre aux besoins de santé modernes, qui représente un enjeu stratégique majeur. Face à une dépendance croissante aux importations et à une concurrence internationale accrue, de nombreux défis technologiques et industriels se posent pour développer cette filière. En France, des efforts conséquents sont déployés, notamment à travers le plan France 2030, pour assurer la souveraineté pharmaceutique et répondre aux besoins médicaux futurs. Cet article explore les défis posés et les opportunités offertes par la bioproduction.
Qu'est-ce que la bioproduction ?
La bioproduction désigne l’ensemble des procédés techniques et industriels utilisés pour la production à grande échelle de molécules biologiques complexes, telles que les protéines thérapeutiques, les anticorps monoclonaux ou les vecteurs viraux pour la thérapie génique et cellulaire. Contrairement aux médicaments chimiques traditionnels, les biomédicaments sont produits à partir de systèmes vivants tels que des cellules de mammifères, des bactéries ou des levures, généralement des cellules génétiquement modifiées, cultivées dans des bioréacteurs dans des conditions strictement contrôlées.
Cette approche permet de produire des traitements spécifiques et efficaces pour de nombreuses pathologies, notamment en oncologie, immunologie, et pour les maladies rares. Les biomédicaments représentent aujourd’hui une part croissante des innovations thérapeutiques, avec environ 50% des essais cliniques en cours. Cependant, la bioproduction présente des défis uniques en termes de complexité, de coûts et de réglementation. Les procédés souvent longs nécessitent un contrôle rigoureux de nombreux paramètres pour garantir la qualité et la sécurité du produit final. Si les investissements de départ sont souvent conséquents par rapport aux méthodes classiques de production, ils sont néanmoins rentables sur le long terme une fois passés à l’échelle.
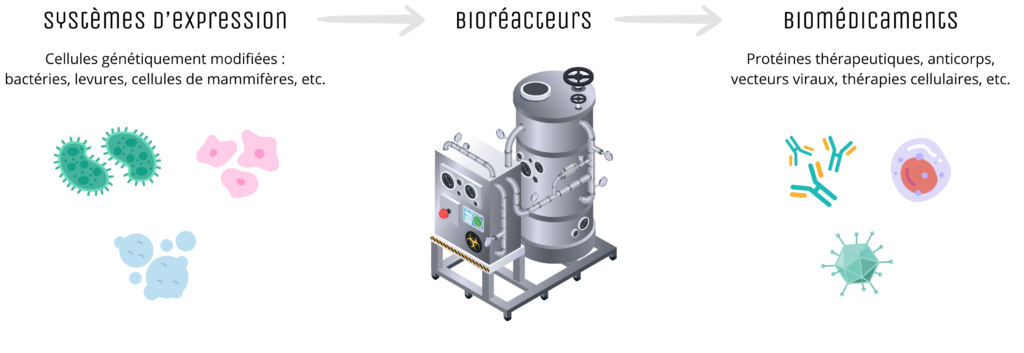
Vision globale simplifiée de la bioproduction
Les enjeux clés de la bioproduction des médicaments biologiques
La conception d’un biomédicament commence par l’identification d’une cible thérapeutique et la sélection d’une molécule biologique capable d’interagir avec cette cible. Cette étape implique souvent des techniques avancées de biologie moléculaire, d’ingénierie des protéines et de bioinformatique. Une fois la molécule conçue, il est nécessaire de développer une lignée cellulaire capable de la produire efficacement. Cela implique l’optimisation des séquences génétiques et la sélection de cellules hôtes appropriées, généralement des cellules de mammifères comme les cellules CHO (Chinese Hamster Ovary).
Le développement de méthodes analytiques robustes est crucial pour caractériser le biomédicament à chaque étape de sa production. Ces méthodes permettent de vérifier l’identité, la pureté et l’activité biologique du produit. Les techniques utilisées incluent la chromatographie liquide haute performance (HPLC), la spectrométrie de masse, l’électrophorèse capillaire et diverses méthodes immunologiques. L’enjeu est de développer des méthodes suffisamment sensibles et spécifiques pour détecter les moindres variations dans la structure ou la composition du biomédicament.
L’utilisation de modèles mathématiques et de simulations numériques devient de plus en plus importante dans l’optimisation des procédés de bioproduction. Les « jumeaux numériques » sont des représentations virtuelles détaillées des systèmes de production qui permettent de prédire et d’optimiser les performances des bioréacteurs. Ces outils aident à réduire le temps et les coûts de développement en permettant d’explorer virtuellement différentes conditions de culture et stratégies de production. Ils contribuent également à améliorer la compréhension des processus biologiques complexes impliqués dans la bioproduction.
La « developabilité » des biomédicaments, aussi appelés biologics, fait référence à la capacité de production à grande échelle d’une molécule, de manière efficace et économique, tout en conservant ses propriétés thérapeutiques. Cette notion englobe plusieurs aspects :
- La stabilité de la molécule pendant la production, le stockage et l’administration
- La solubilité et la tendance à l’agrégation
- La facilité de purification
- La biodisponibilité et la pharmacocinétique
L’évaluation et l’optimisation de la developabilité dès les premières étapes de conception sont essentielles pour éviter des problèmes coûteux lors des phases ultérieures de développement et de production.
La production de biomédicaments est soumise à des réglementations strictes pour garantir la sécurité et l’efficacité des produits. Les Bonnes Pratiques de Fabrication (BPF) doivent être rigoureusement suivies tout au long du processus de production. Le concept de « Qualité par la Conception » (Quality by Design, QbD) est de plus en plus adopté dans l’industrie biopharmaceutique. Cette approche vise à intégrer la qualité dès la conception du produit et du procédé, en identifiant les attributs critiques de qualité et en contrôlant les paramètres critiques du procédé. Les autorités réglementaires, telles que l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) en France, l’Agence Européenne des Médicaments (EMA) et la Food and Drug Administration (FDA) américaine, exigent une documentation exhaustive sur tous les aspects de la production, y compris la caractérisation du produit, la validation des procédés et les contrôles en cours de fabrication.
Les défis stratégiques d’avenir pour la filière bioproduction
2020 : le tournant de la pandémie de Covid-19
La pandémie de Covid-19 a marqué un tournant pour la bioproduction, en mettant subitement en lumière son importance stratégique et les vulnérabilités des chaînes d’approvisionnement pharmaceutiques mondiales. La course au développement et à la production de vaccins à ARN messager a démontré la capacité d’innovation et d’adaptation rapide de l’industrie biopharmaceutique. Cependant, cette crise a également révélé la dépendance de nombreux pays, dont la France, vis-à-vis des importations de produits biologiques essentiels. Par exemple, 97% des anticorps monoclonaux prescrits en France sont produits à l’étranger. Cette situation a conduit à une prise de conscience collective de la nécessité de renforcer les capacités de bioproduction nationales et européennes, non seulement pour les vaccins, mais pour l’ensemble des biomédicaments.
Capacités de bioproduction mondiales
Le marché mondial de la bioproduction connaît une croissance rapide, stimulée par la demande croissante de biomédicaments et l’émergence de nouvelles thérapies innovantes comme les thérapies géniques et cellulaires. Aux États-Unis et au Canada, l’industrie de la bioproduction est mature et bénéficie d’un écosystème d’innovation dynamique, avec de nombreuses entreprises de biotechnologie et des capacités de production importantes.
En Europe, bien que certains pays comme l’Allemagne et la Suisse aient une forte présence dans ce secteur, la région cherche globalement à renforcer ses capacités pour réduire sa dépendance aux importations.
L’Asie, en particulier la Chine et la Corée du Sud, investit massivement dans la bioproduction, avec la construction de nombreuses installations de grande capacité et des coûts de production souvent inférieurs à ceux de l’Europe et des États-Unis.
Dans ce contexte, la France doit relever plusieurs défis pour se positionner comme un acteur majeur :
- Accélérer le développement de ses capacités de production
- Investir dans la formation et l’attraction des talents
- Soutenir l’innovation dans les technologies de bioproduction
- Créer un environnement réglementaire et fiscal favorable aux investissements dans ce secteur
En France, la production de vaccins est l’activité de bioproduction la plus développée, représentant plus de 8 500 emplois. Cependant, le pays fait face à des défis, notamment un manque de relais entre les grands groupes pharmaceutiques et les sociétés de biotechnologie, principalement constituées de start-ups.
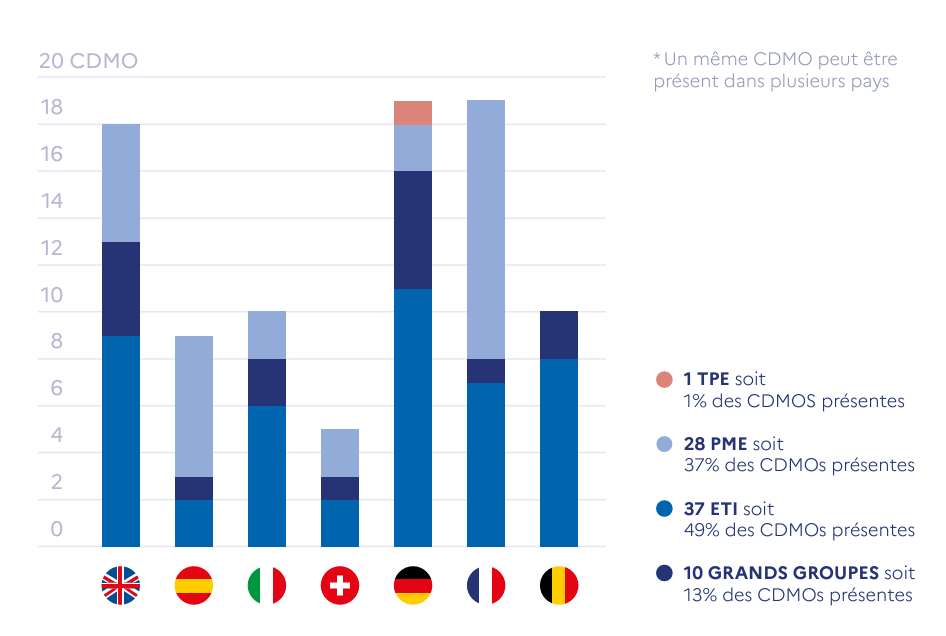
Paysage des CDMO en Europe – Issu de l’étude et caractérisation de la filière des biomédicaments en France, France 2030 (voir sources)

Sites de production – Issu de l’étude et caractérisation de la filière des biomédicaments en France, France 2030 (voir sources)
France 2030, un plan d'investissement et un enjeu de souveraineté majeur

Face à ces défis, le gouvernement français a lancé en 2021 le plan « France 2030 », qui inclut un volet important dédié à la bioproduction. Ce plan vise à faire de la France un leader européen dans ce domaine stratégique d’ici 2030. Les objectifs principaux de ce plan sont :
- Augmenter significativement les capacités de production nationales
- Soutenir l’innovation dans les technologies de bioproduction
- Former les talents nécessaires à cette industrie en pleine croissance
- Renforcer l’attractivité de la France pour les investissements dans ce secteur
Le plan prévoit des investissements massifs, notamment à travers le « Grand Défi Biomédicaments », qui soutient des consortiums public-privé travaillant sur des innovations clés telles que :
- Le développement d’outils de pilotage avancés pour les lignes de bioproduction
- La création de dispositifs robotiques innovants pour améliorer la flexibilité et la sécurité dans les usines du futur
- Le développement de nouveaux systèmes biologiques pour produire les biomédicaments de demain
Ces initiatives visent à réduire les coûts de production, augmenter les rendements et améliorer la qualité des biomédicaments, tout en garantissant la sécurité des patients.
Quels acteurs pour développer et produire les biomédicaments en France ?
Le paysage de la bioproduction en France est composé de divers acteurs :
- Les instituts de recherche et les universités : ils contribuent à l’innovation et à la formation des futurs experts en bioproduction.
- Les biotechs : ces entreprises innovantes, souvent issues de la recherche académique, jouent un rôle crucial dans le développement de nouvelles molécules biologiques.
- Les Contract Development and Manufacturing Organizations (CDMOs) : ces entreprises spécialisées offrent des services de développement et de production pour le compte d’autres sociétés.
- Les grandes entreprises pharmaceutiques : elles disposent des ressources nécessaires pour mener des projets de bioproduction à grande échelle.
La collaboration entre ces différents acteurs est essentielle pour créer un écosystème dynamique et compétitif.
Communication et évènements pour dynamiser la filière de la bioproduction
Pour stimuler le développement de la filière bioproduction en France, plusieurs initiatives de communication et d’événements sont mises en place :
- Annuaire sectoriel : Un outil collaboratif baptisé “Mon Partenaire en Biotherapie” lancé en 2024 par le LEEM, France BioLead et MabDesign recense les acteurs de la filière Française de la bioproduction et vise à mettre en valeur l’expertise des entreprises du réseau et à faciliter la recherche de partenaires pour les acteurs du secteur.
- Conférences et salons professionnels : Ces événements permettent aux acteurs de la filière de se rencontrer, d’échanger sur les dernières avancées et de nouer des partenariats. MabDesign organise notamment chaque année son Bioproduction Congress, et publie ensuite un rapport détaillé des sessions sous forme d’une édition spéciale de Bioprocess Watch.
- Programmes de formation : Des initiatives sont lancées pour former les futurs professionnels de la bioproduction et répondre aux besoins croissants en main-d’œuvre qualifiée. MabDesign dispose d’une offre de formations ciblées de tout niveaux sur la bioproduction.
- Campagnes de sensibilisation : Des efforts sont faits pour informer le grand public sur l’importance des biomédicaments et de la bioproduction pour la santé publique.
- Plateformes de collaboration : Des initiatives sont mises en place pour faciliter les collaborations entre les différents acteurs de l’écosystème (entreprises, laboratoires de recherche, institutions publiques).

Conclusion
La bioproduction représente un enjeu stratégique majeur pour la France et l’Europe, tant sur le plan de la santé publique que de l’indépendance économique. Les défis sont nombreux, allant de l’innovation technologique à la formation des talents, en passant par la mise en place d’un cadre réglementaire adapté.
Le plan France 2030 et les initiatives associées témoignent de la volonté politique de positionner la France comme un leader dans ce domaine crucial. Cependant, le succès de cette ambition dépendra de la capacité du pays à mobiliser efficacement ses ressources, à favoriser la collaboration entre recherche publique et industrie, et à s’adapter rapidement aux évolutions technologiques et aux besoins du marché.
L’enjeu est de taille : il s’agit non seulement de garantir l’accès des patients français et européens à des traitements innovants et de plus en plus personnalisés afin de s’adapter aux besoins spécifiques des patients, mais aussi de créer une industrie de pointe génératrice d’emplois qualifiés et de valeur ajoutée pour l’économie nationale.
Ne ratez pas la 10ème édition du Congrès Bioproduction (BIOPC2025), organisé par MabDesign, qui se tiendra les 22 et 23 septembre 2025 à Lyon. Les acteurs de la filière biothérapie y échangent sur l’avenir de la bioproduction, les défis actuels et présentent les dernières innovations.
Si vous avez un projet autour de la bioproduction, ou plus largement des biomédicaments, n’hésitez pas à aller voir notre offre de services, et à nous contacter pour échanger. Nous serons ravis de mettre à profit notre expertise pour vous aider à atteindre vos objectifs !
Pour rester à la pointe des connaissances et de l’innovation, jetez également un œil à nos formations autour de la bioproduction.
Sources
- Expertise et données MabDesign
- Bioproduction de protéines thérapeutiques : Revue et perspectives. Med Sci (Paris) 2009 ; 25 : 18–26
- Revue des bioproductions de santé en France. Tanguy Lemasson. Sciences pharmaceutiques (2022)
- Le Monde – La France tente de combler son retard dans les biomédicaments (17/06/2024)
- BioProcessWatch Analytical tools in bioprocessing. Edition 2023. MabDesign
- Investir dans la France 2030 : devenir un leader de la production de thérapies innovantes. Ministère de l’Enseignement Supérieur et de la Recherche, Communiqué de presse (07/01/2022
- Étude et caractérisation de la filière des biomédicaments en France. Etude réalisée en 2023 par Mabdesign pour France 2030, l’Agence de l’innovation en santé et sa stratégie d’accélération Biomédicaments et Bioproduction en thérapies innovantes, France Biotech et France Biolead