Les biomédicaments ou biothérapies occupent une place grandissante sur le marché, et constituent un espoir immense pour le traitement de nombreuses pathologies. Des premières découvertes autour des vaccins jusqu’au développement récent des thérapies cellulaires et géniques en passant par la médecine régénérative, l’histoire des biomédicaments permet de retracer les grandes avancées de cette véritable révolution de l’industrie pharmaceutique et de la médecine moderne.
Découvertes fondamentales et définition des biomédicaments
Tout commence à la fin du XIXème siècle, marqué par des découvertes fondamentales en biologie et en chimie. Historiquement, le traitement des maladies se basait sur l’utilisation de remèdes naturels : cette tradition est bouleversée en 1869 par l’arrivée du premier médicament synthétique, l’hydrate de chloral. Cette avancée est suivie de près par le développement de nombreuses autres « petites molécules chimiques » dérivées de remèdes naturels, telles que l’aspirine en 1897.
En parallèle, l’histoire des biomédicaments débute avec celle des vaccins : suite aux expériences historiques d’Edward Jenner et de Louis Pasteur, les vaccins et les thérapies à base de sérum se développent. Cependant, ces premières expériences sont confrontées à d’importants défis, notamment en termes de compréhension des mécanismes d’action biologiques sous-jacents, de sécurité, et d’acceptation sociale.
C’est à cette époque qu’apparait la première définition de « biomédicament » : ils sont alors définis comme des médicaments ayant une origine « naturelle » (plantes ou animaux), par opposition à ceux obtenus par synthèse chimique.
Plus gros et plus complexes que leurs homologues chimiques, les premiers biomédicaments se heurtent à un obstacle important : les difficultés de production, notamment en termes de rendement et de sûreté. On peut citer les exemples de l’hormone de croissance hGH, qui devait être extraite de cadavres, ou encore de l’insuline, qui nécessitait une extraction à partir de pancréas de porc ou de bovins.
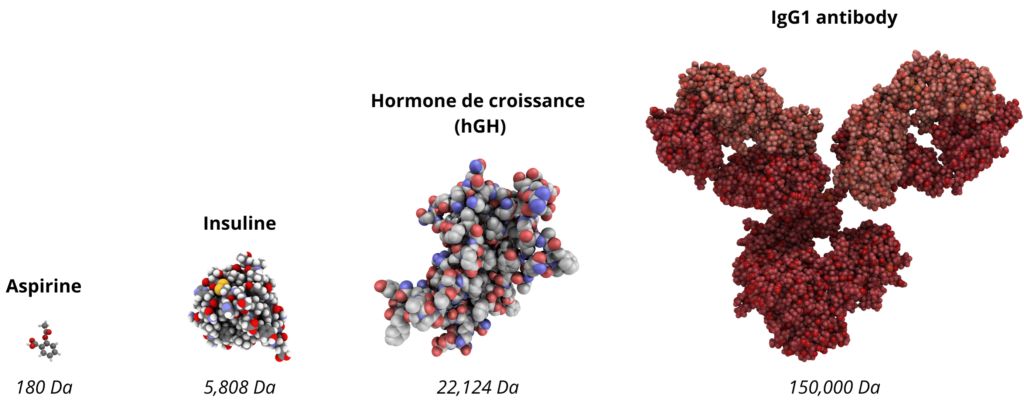
Structures et taille des molécules d’aspirine, d’insuline, d’hGH et d’IgG1. Les biomédicaments ont une taille et une complexité structurelle plus importantes que les petites molécules.
La révolution des biotechnologies
Le XXème siècle est marqué par des avancées en génie génétique et en biologie moléculaire : les bases de la thérapie biomédicale sont posées avec le décodage de la structure de l’ADN (1953), et le développement de techniques de recombinaison génétique et de biologie moléculaire (1970s). Ces techniques deviennent des outils essentiels pour la conception et la production de biomédicaments.
Les progrès réalisés, conjugués à l’accumulation croissante de connaissances sur le système immunitaire et les processus biologiques, ont ouvert de nouvelles perspectives pour le développement de thérapies innovantes, notamment en améliorant grandement les modes de production et leurs rendements. Ces avancées amènent également à une redéfinition des biomédicaments : ils sont désormais définis comme des agents dont les composants ou les origines sont naturels, et qui sont construits ou produits avec l’aide de la bio-ingénierie ou de la biotechnologie.
En s’appuyant sur ces nouveaux outils, les années 70-80 voient donc le développement de nouvelles biothérapies : l’une des plus marquantes est l’insuline humaine recombinante produite par génie génétique. C’est une grande avancée pour le traitement du diabète : auparavant, 2 tonnes de pancréas de porc étaient nécessaires pour produire 200g d’insuline de porc. L’insuline recombinante pouvant être produite en grande quantité, elle est accessible à beaucoup plus de patients. Elle est aussi plus efficace, et cause moins d’effets secondaires.
Néanmoins, la production de ces « grosses molécules », 200 à 1000 fois plus grandes, et également plus complexes que les petites molécules chimiques, demeure un défi important encore aujourd’hui.
Les anticorps monoclonaux : l’avènement des biomédicaments
Le développement de la technique de production des hybridomes, mise au point par Georges Köhler et Cesar Milstein en 1975 et récompensée par un Prix Nobel, marque l’arrivée des anticorps monoclonaux (mAbs) : cette technique permet la production d’un ensemble d’anticorps identiques (un clone) dirigés contre un antigène spécifique. Comparés aux anticorps polyclonaux (plusieurs clones différents) issus de sérums de patients convalescents ou d’animaux, les anticorps produits de cette façon sont homogènes et mono-spécifiques.
En 1985, le premier anticorps monoclonal est commercialisé pour une utilisation clinique : le muromonab-CD3, pour le traitement du rejet de greffe. Dans les années qui suivirent, l’arrivée des mAbs a marqué un tournant dans le traitement des maladies auto-immunes et des cancers, en apportant des solutions thérapeutiques pour la polyarthrite rhumatoïde, certains lymphomes et cancers du sein, ou encore la maladie de Crohn. Pour les maladies auto-immunes, les mAbs peuvent cibler des protéines spécifiques impliquées dans la réponse immunitaire excessive, réduisant ainsi l’inflammation et les dommages aux tissus sans nécessairement provoquer une forte immunosuppression systémique. En oncologie, ils apportent des traitements plus ciblés, basés sur les marqueurs exprimés par une tumeur donnée. Ils sont ainsi efficaces et mieux tolérés que les traitements conventionnels comme la chimiothérapie, et ouvrent la voie à une médecine personnalisée pour le traitement des cancers.
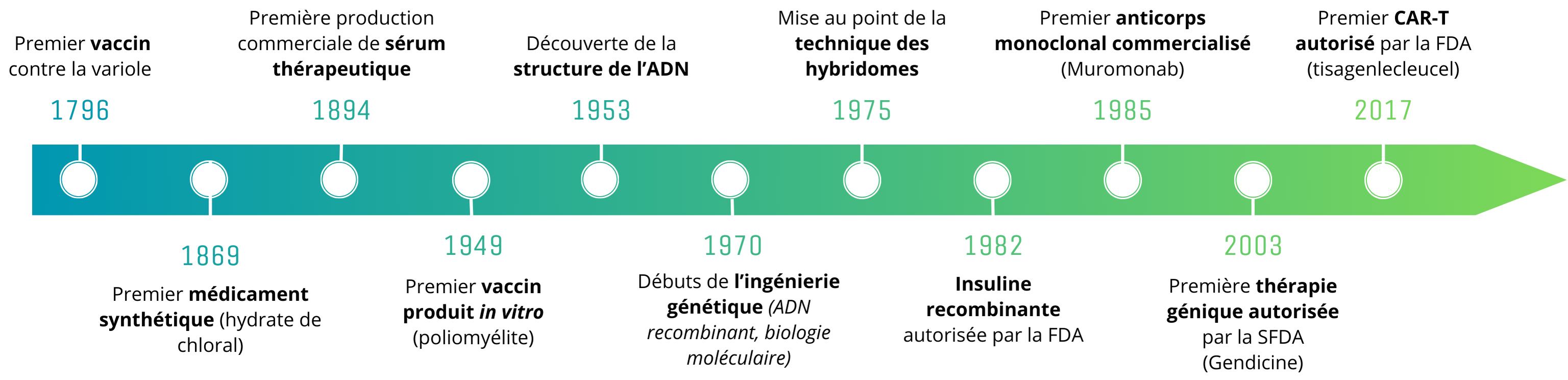
Chronologie des grandes avancées liées aux biomédicaments
L'expansion du panel et du champ d'application des biomédicaments
Aujourd’hui, les biomédicaments sont utilisés dans le traitement de maladies aussi diverses que le diabète, les maladies cardiovasculaires, les troubles neurologiques ou encore les infections virales. Cette expansion du champ d’application a été possible grâce à de nombreuses innovations amenant à de nouveaux types de biomédicaments.
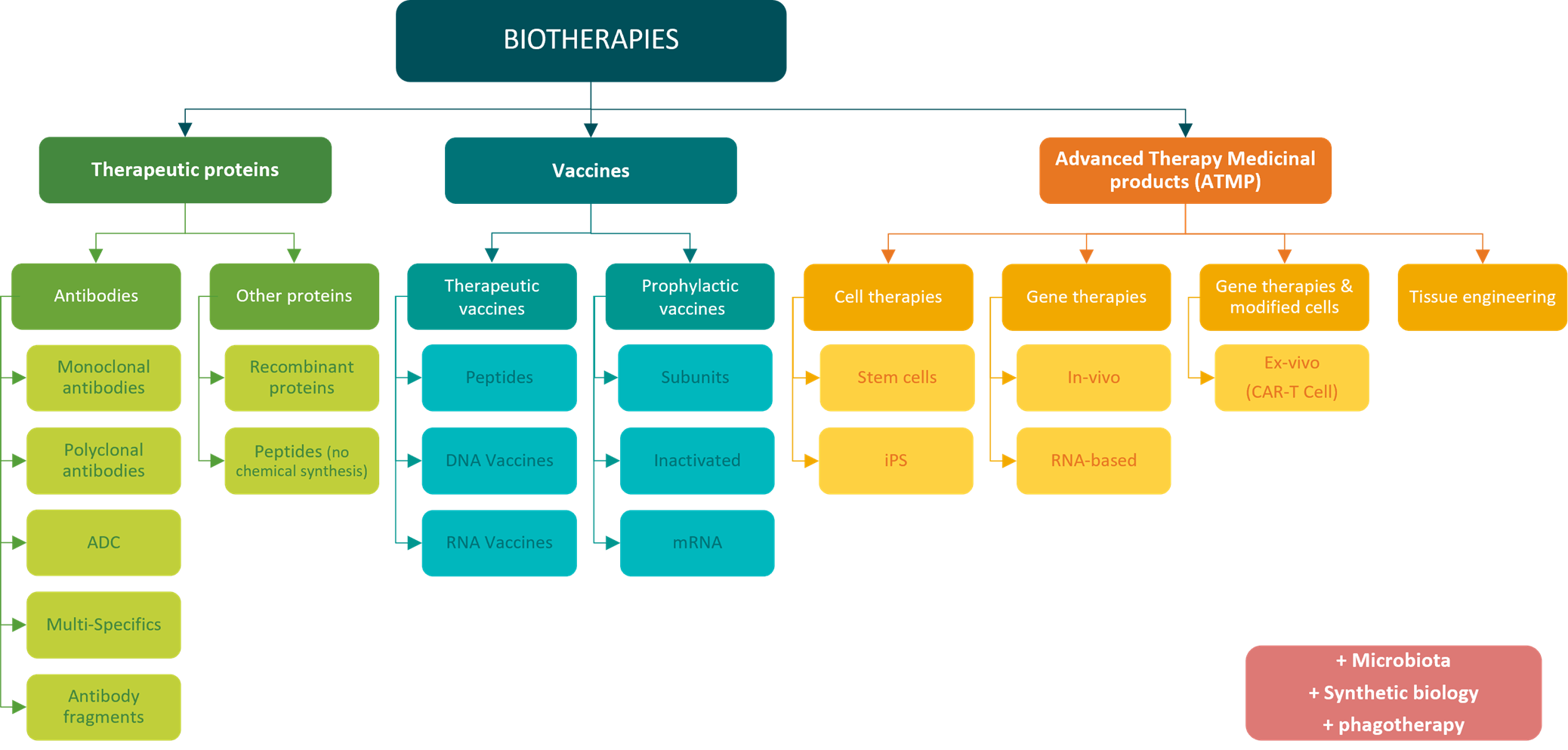
Classification des biothérapies par grandes familles – MabDesign
Les protéines thérapeutiques se diversifient, avec l’apparition de nombreuses nouvelles technologies : les anticorps multi-spécifiques, les antibody-drug conjugates (ADCs), les fragments d’anticorps, les peptides, les protéines recombinantes, etc.
Les vaccins sont également porteurs d’innovation : une grande diversité de technologies a été développée au cours du temps en sus des technologies classiques d’atténuation et d’inactivation, comme les vaccins sous-unitaires, à ARNm, à ADN, etc. La diversité de notre arsenal de vaccins prophylactiques a récemment été sous les feux des projecteurs lors de la pandémie du COVID-19 (voir notre immunowatch édition spéciale COVID-19). D’autre part, au-delà des approches historiquement prophylactiques, les vaccins se présentent dorénavant également comme un outil thérapeutique potentiel, principalement en oncologie.
De nouvelles familles de biomédicaments apparaissent avec les médicaments de thérapies innovantes (MTIs), regroupant l’ingénierie tissulaire, et les thérapies géniques et cellulaires. Ces dernières constituent un nouveau traitement prometteur : corriger les défauts génétiques à l’origine de certaines maladies, remplacer les cellules endommagées par des cellules saines ou améliorer le pouvoir thérapeutique de nos cellules. Les cellules CAR-T par exemple, sont conçues en modifiant génétiquement les lymphocytes T d’un patient pour qu’ils expriment des récepteurs chimériques (CAR) spécifiquement conçus pour cibler et détruire les cellules cancéreuses. Une fois réinjectées dans le corps du patient, les cellules CAR-T peuvent cibler de manière précise les cellules cancéreuses et déclencher une réponse immunitaire hautement efficace contre la tumeur.
Ces approches offrent de nouvelles possibilités de traitement pour un large éventail de maladies, notamment les maladies génétiques, les maladies du sang, les troubles neurologiques et les cancers. Bien que ces thérapies soient encore en cours de développement, et aient encore de nombreux défis à relever, elles représentent un domaine d’investigation majeur à l’heure actuelle. Avec un pipeline considérable et dynamique de candidats MTI en développement, nous assistons régulièrement à des nouvelles prouesses thérapeutiques.
Février 2024
La première thérapie génique approuvée par l'UE
La Commission Européenne a accordé en février 2024 une autorisation de mise sur le marché pour une thérapie génique basée sur la technologie CRISPR/Cas9 (CASGEVY®), pour le traitement de la drépanocytose et de la bêta-thalassémie dépendante des transfusions. C’est la première thérapie génique approuvée par l’Union Européenne, qui pourrait être administrée à plus de 8 000 patients.
Enfin, on peut également citer des innovations telles que la phagothérapie, les thérapies microbiotiques, ou encore la biologie synthétique, qui apparaissent elles aussi dans le paysage grandissant des biomédicaments.
Défis et perspectives
Aujourd’hui, en comparaison des petites molécules chimiques, relativement peu de biomédicaments sont sur le marché. Néanmoins, leur contribution à la lutte contre de nombreuses pathologies est immense. Cette répartition va probablement évoluer dans le futur, car plus de la moitié des molécules actuellement en développement sont des biothérapies.
Cependant, des défis persistent, notamment en termes d’accessibilité, de coûts et de réglementations. Les systèmes de santé doivent faire face à la prise en charge complexe de ces traitements, beaucoup plus coûteux que les thérapies plus classiques. La bioproduction de ces molécules reste également un enjeu majeur du secteur, et un vecteur important d’innovation.
Le secteur des biomédicaments est constamment porté par l’innovation, ce qui rend les définitions et catégorisations pour le moins mouvantes. De nouvelles approches sont développées continuellement, rendant le domaine à la fois passionnant et exigeant en termes de connaissances du marché et des technologies émergentes.
Pour vous aider à mieux connaître ce marché, n’hésitez pas à aller voir les différentes offres de MabDesign. Des formations et des congrès pour rester à la pointe des connaissances, des analyses marketing pour comprendre et segmenter vos marchés, un accompagnement commercial pour cibler et élargir votre clientèle, des veilles pour détecter les opportunités et les innovations, ou encore des accompagnements pour financer vos innovations : contactez-nous !
Sources
- Données et expertise MabDesign
- The History of Biologics: Problems, Perseverance, and Potential–Beckman
- A fascinating story of the discovery & development of biologicals for use in clinical medicine – Malaviya et al., 2018
- The Biologics Revolution in the Production of Drugs – Fraser Institute
- Biopharmaceutical Manufacturing: Historical Perspectives and Future Directions, Alana C. Szkodny and Kelvin H. Lee, Annual Review of Chemical and Biomolecular Engineering 2022 13:1, 141-165
- La bioproduction des anticorps monoclonaux, Joubert et al., 2019
- Jones AW. Early drug discovery and the rise of pharmaceutical chemistry. Drug Test Anal. 2011 Jun;3(6):337-44. doi: 10.1002/dta.301. PMID: 21698778.
- Biotechinfo.fr
Abréviations
hGH : human growth hormone
mAb : monoclonal antibody
FDA : Food and Drug Administration
SFDA : Chinese State Food and Drug Authority
CAR : chimeric antigen receptor
ADC : antibody-drug conjugates
MTI : médicaments de thérapies innovantes