La culture cellulaire est la pierre angulaire de la recherche biomédicale et de l’innovation en biotechnologie. Bien que la bioproduction de biomédicaments en bioréacteurs soit aujourd’hui la norme et que l’utilisation des organoïdes et des « organ-on-a-chip » (OoC) se développe, les débuts de la mise en culture de cellules in vitro furent plus modestes.
La découverte des cellules
Les cellules, nommées par un scientifique...
L’histoire de la culture cellulaire débute avant toute chose avec la découverte des cellules elles-mêmes, laquelle est intimement liée à l’évolution du microscope : c’est l’amélioration du grossissement permis par les lentilles qui permettra l’observation des cellules pour la première fois.
En 1665, Robert Hooke utilisa pour la première fois le terme « cellule ». En examinant du liège sous un microscope, Hooke remarque qu’il est constitué de petites chambres qu’il appelle alors « cellules » parce qu’elles lui rappelaient les chambres des moines dans un monastère, cellula en latin. Cependant, Hooke observe alors uniquement des parois cellulaires de cellules végétales mortes, et non des cellules vivantes.
... mais découvertes par un drapier
Ce n’est pas un scientifique, mais un drapier néerlandais, Antonie van Leeuwenhoek, qui observa pour la première fois des cellules vivantes au microscope. Passionné par la fabrication de lentilles et la microscopie, qu’il utilise notamment pour examiner la qualité de ses étoffes, il a en effet perfectionné le polissage de lentilles jusqu’à obtenir un grossissement de 300 fois. Un exploit pour l’époque, puisque les microscopes à plusieurs lentilles élaborés par Hooke n’atteignaient alors qu’un grossissement de 30 à 40 fois.
En 1674, Van Leeuwenhoek est donc le premier à observer des micro-organismes et des cellules grâce à ses ingénieux microscopes. Il décrit alors avec précision ce qu’il observe dans une lettre adressée à la Royal Society de Londres : ses premières observations comprenaient des bactéries, des protozoaires et des cellules sanguines. Il nomme les petits êtres vivants qu’il voit à travers son microscope « animacules ». Ainsi, bien que sans éducation scientifique, Antonie van Leeuwenhoek est considéré par certains comme le tout premier biologiste cellulaire.
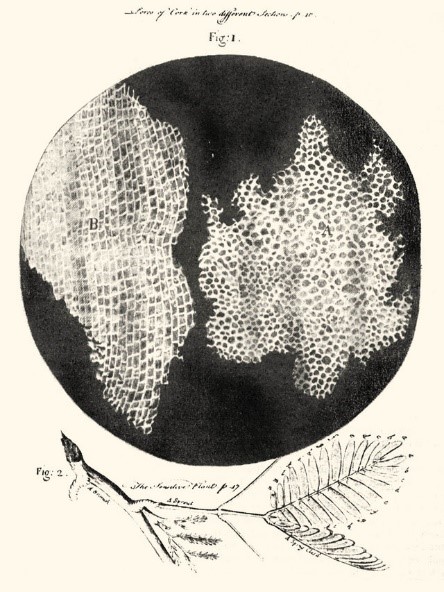
Robert Hooke, Micrographia (extrait), 1665. Dessin de la structure cellulaire du liège et d’un brin de la plante sensible

Un des microscopes d’Antonie van Leeuwenhoek, vers la fin du XVIIème siècle
Ces découvertes fondamentales constituent le démarrage de ce qui deviendra par la suite la théorie cellulaire, qui constitue aujourd’hui la base de notre compréhension de la structure des organismes vivants.
Les débuts de la culture cellulaire
Les pionniers de la culture tissulaire
Suite à la découverte des cellules, les scientifiques ont progressivement développé des techniques pour les étudier en dehors de leur organisme d’origine : les premières expérimentations visaient donc à comprendre comment maintenir et observer les tissus vivants in vitro.
L’une des premières tentatives connues est celle de Wilhelm Roux, un embryologiste allemand, qui a maintenu des cellules de moelle épinière de poulet en vie dans une solution saline pendant quelques jours. Un des premiers succès significatifs est attribué à Ross Harrison, un zoologiste américain, et à sa technique « hanging drop », qui consistait à placer des fragments de tissu dans des gouttes de lymphe coagulée. Réalisés en 1907, ses travaux ont non seulement démontré que les cellules pouvaient survivre et se développer in vitro, mais aussi qu’elles pouvaient maintenir des interactions spécifiques, comme la croissance des axones neuronaux.
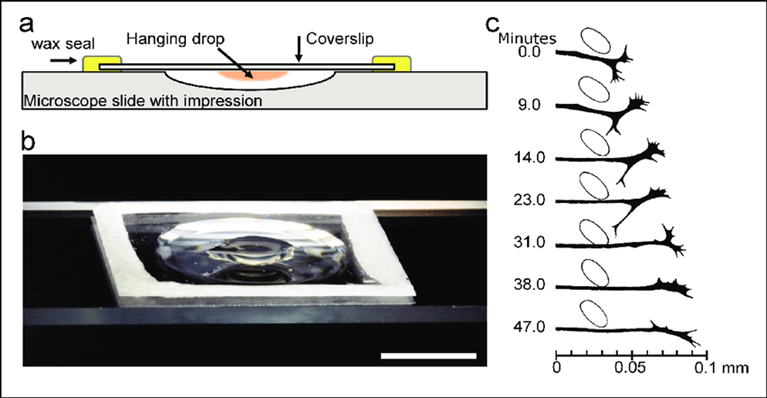
Issu de Millet, Larry & Gillette, Martha. (2012). Over a Century of Neuron Culture: From the Hanging Drop to Microfluidic Devices.
Alexis Carrel, un chirurgien français, et son assistant Montrose Burrows adoptent ensuite cette technique en remplaçant la lymphe par du plasma et en ajoutant un mélange de sérum, de solution saline et un extrait d’embryon de poussin. Ce mélange qu’ils nomment milieu plasmatique, devient une norme jusque dans les années 1950. Ils posent ainsi les bases de la culture tissulaire qu’ils définissent comme « un milieu plasmatique ensemencé de petits fragments de tissus vivants ».
Ayant réussi à maintenir des cellules en culture pendant 34 ans, Carrel était fermement convaincu que les cellules primaires en culture étaient immortelles si elles étaient maintenues dans un milieu nutritif approprié. La démonstration définitive de cette erreur a été apportée par Leonard Hayflick, qui a démontré en 1965 que les fibroblastes humains normaux ne survivent pas in vitro au-delà d’environ 50 divisions : ce qui est aujourd’hui connu comme la « limite de Hayflick ». La survie de la culture de Carrel était probablement due à l’apport de nouvelles cellules provenant de l’extrait embryonnaire contenu dans le milieu.
Par la suite, ces techniques de culture se développent, et des cellules primaires peuvent être prélevées à partir d’une variété de sources, séparées par la trypsine et cultivées en monocouche avec un milieu approprié contenant du sérum.
La révolution des cellules HeLa
En 1951, Henrietta Lacks, une femme afro-américaine de 31 ans, se rend à l’hôpital Johns-Hopkins pour se faire examiner à cause d’une douleur au ventre. On lui diagnostique un cancer du col de l’utérus : une tumeur au développement extrêmement rapide.
Sans son consentement, le Dr. George Otto Gey fait une biopsie et mets en culture les cellules du carcinome, s’attendant à ce qu’elles meurent après quelques divisions, comme la plupart des échantillons. Cependant, les cellules étiquetées « HeLa » ont non seulement survécu, mais se sont révélées avoir des capacités de prolifération hors du commun, n’étant pas soumises à la limite de Hayflick.
De ces cellules immortelles de la tumeur qui emporta Henrietta Lacks 8 mois plus tard, est née la première lignée cellulaire stable, qui a révolutionné la recherche biomédicale. Ce sont plus de 50 millions de tonnes de cellules HeLa qui ont été distribuées dans le monde, pour plus de 75 000 études. En 2021, l’OMS a même décerné une distinction à Henrietta Lacks à titre posthume, pour saluer sa contribution aux sciences médicales.

Henrietta Lacks
Comment les cellules HeLa ont-elles acquis ces caractéristiques hors du commun ?
Les capacités exceptionnelles des cellules HeLa sont le résultat d’une combinaison de facteurs. Tout d’abord, les HeLa ont 76 à 80 chromosomes, en raison d’une infection par le virus HPV qui a provoqué l’accumulation d’erreurs dans le génome au fur et à mesure des divisions. D’autre part, les cellules HeLa se développent encore plus rapidement que la plupart des cellules cancéreuses : les chercheurs attribuent ce phénomène au fait qu’Henrietta Lacks était également atteinte de syphilis, une maladie qui affaiblit le système immunitaire et permet aux cancers de se développer de manière agressive. Enfin, les cellules HeLa peuvent se diviser un nombre infini de fois grâce à une surexpression de la télomérase, qui permet de maintenir les télomères à longueur constante malgré le grand nombre de divisions.
Par la suite, les chercheurs développent de nombreuses autres lignées cellulaires, à partir de cellules cancéreuses, ou en « immortalisant » des cellules non cancéreuses. Aujourd’hui, le catalogue ATCC (American Type Culture Collection) contient plus de 4000 lignées humaines et animales, à disposition des chercheurs et industriels du monde entier.
Optimisation des conditions de culture cellulaire
Bien que les lignées cellulaires permettent de stabiliser la culture in vitro, les milieux de culture sont quant à eux basés sur des fluides comme le sérum ou des extraits tissulaires, ce qui entraîne une grande variabilité et des problèmes de contamination.
Dans les années 50, Harry Eagle, un médecin et biologiste américain, entreprend de créer un milieu de culture défini et reproductible qui pourrait soutenir la croissance cellulaire de manière constante. Ses recherches lui permettent d’identifier plusieurs composants essentiels pour maintenir les cellules en culture : les acides aminés, les vitamines, les sels minéraux, et le glucose. En sus, bien que l’objectif d’Eagle fût de minimiser l’utilisation de composants biologiques non définis, le sérum de veau fœtal (FBS, pour fœtal bovine serum) était souvent ajouté pour fournir des facteurs de croissance et d’autres nutriments non spécifiquement identifiés.
En s’appuyant sur ces composant essentiels, Eagle mets au point en 1965 son milieu de culture cellulaire standardisé, Eagle’s Minimum Essential Medium (MEM). Le MEM a servi de base à d’autres milieux de culture améliorés, comme le DMEM (Dulbecco’s Modified Eagle Medium), qui contient des concentrations plus élevées de certains nutriments pour soutenir la croissance de cellules plus exigeantes. Il est encore aujourd’hui omniprésent dans les laboratoires, en raison de sa capacité à soutenir une large gamme de types cellulaires.
En parallèle de la standardisation du milieu de culture, les conditions de culture sont également standardisées et optimisées : développement des incubateurs à CO2, des techniques aseptiques, utilisation des antibiotiques, etc. Cette standardisation des techniques de culture cellulaire améliore la reproductibilité des expériences, et permets de nombreuses avancées.

Bouteilles de milieu de culture DMEM
La technique des hybridomes
Avant 1975, les anticorps utilisés pour la recherche et les applications thérapeutiques étaient généralement produits à partir de sérums d’animaux immunisés. Cette méthode présentait plusieurs limitations, notamment la variabilité, une quantité disponible limitée, ainsi qu’une faible spécificité. En 1975, Georges Köhler et César Milstein mettent au point la technique des hybridomes : elle repose sur la fusion de cellules de myélome, pouvant se diviser indéfiniment, avec des lymphocytes B provenant de la rate de souris immunisées, capables de produire des anticorps. Les cellules fusionnées (hybridomes) sont ensuite sélectionnées dans un milieu spécifique qui permet uniquement la survie des cellules fusionnées. Cette technique a permis la production à grande échelle d’anticorps monoclonaux standardisés, et a valu à Köhler et Milstein le Prix Nobel de Physiologie ou Médecine en 1984.
Conclusion et perspectives
Depuis la découverte des cellules à la fin du XVIIème siècle, la culture cellulaire a constamment évolué pour devenir de nos jours l’une des technologies indispensables en recherche biomédicale et en biotechnologie. Les dernières avancées dans le domaine continuent de transformer le paysage scientifique : les techniques novatrices telles que la microfluidique, la culture 3D, les organoïdes, ou encore le bioprinting permettent de modéliser des tissus et des organes complexes, offrant des modèles in vitro de plus en plus réalistes pour mieux étudier la complexité des processus biologiques et faciliter le développement de médicaments. Les milieux de culture ont également leur lot d’innovation, pour répondre aux nouveaux enjeux de bioproduction (milieux sans sérum, sans produits d’origine animale, pour la médecine régénérative, etc.).
Parallèlement, les procédés de bioproduction industrielle s’améliorent continuellement, avec des bioréacteurs de plus en plus sophistiqués, des systèmes de culture en continu, ou encore l’utilisation de microcarriers. Ces innovations promettent d’améliorer la production à grande échelle de biomolécules thérapeutiques, ce qui permettrait de les rendre plus personnalisables, d’en diminuer les coûts de production et d’élargir l’accès à ces biothérapies.
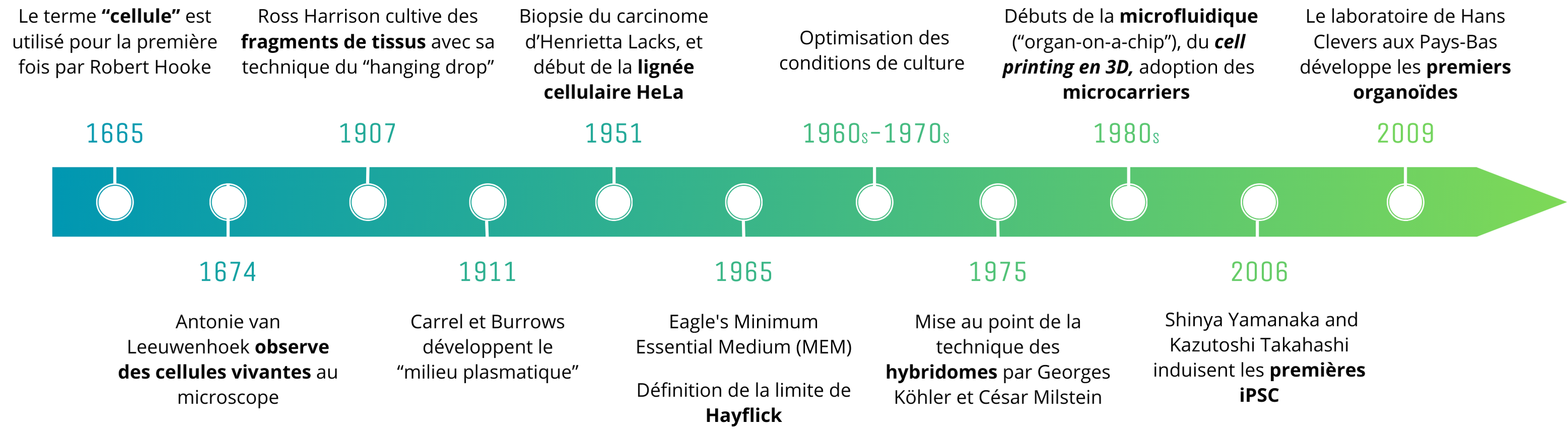
Historique des grandes avancées de la culture cellulaire
MabDesign est expert des biomédicaments et de la bioproduction. Pour vous aider à mieux connaître ces marché, n’hésitez pas à aller voir nos différentes offres. Des formations et des congrès pour rester à la pointe des connaissances, des analyses marketing pour comprendre et segmenter vos marchés, un accompagnement commercial pour cibler et élargir votre clientèle, des veilles pour détecter les opportunités et les innovations, ou encore des accompagnements pour financer vos innovations : contactez-nous !
Sources
- Données et expertise MabDesign
- Millet, Larry & Gillette, Martha. (2012). Over a Century of Neuron Culture: From the Hanging Drop to Microfluidic Devices.
- Gu, Z., Fu, J., Lin, H., & He, Y. (2020). Development of 3D bioprinting : From printing methods to biomedical applications.
- Hudu, S. A., Alshrari, A. S., Syahida, A., & Sekawi, Z. (2016). Cell Culture, Technology : Enhancing the Culture of Diagnosing Human Diseases.
- Jedrzejczak-Silicka, M. (2017). History of Cell Culture.
- Taylor, M. W. (2014a). A History of Cell Culture. In M. W. Taylor (Éd.), Viruses and Man : A History of Interactions (p. 41‑52).
- J.-F. LESESVE (2020) Antonie van Leeuwenhoek, le découvreur des globules rouges
Abréviations
OoC – Organ-on-chips
OMS – Organisation Mondiale de la Santé
ATCC – American Type Culture Collection
FBS – Fœtal Bovine Serum
MEM – Eagle’s Minimum Essential Medium
DMEM – Modified Eagle’s Medium