Les Médicaments de Thérapie Innovante (MTI) émergent dans un contexte scientifique et médical caractérisé par des avancées significatives dans la compréhension des mécanismes moléculaires et cellulaires des maladies. Cette révolution s’inscrit dans le prolongement des découvertes en génétique, en biologie moléculaire et en immunologie, offrant de nouvelles perspectives pour le traitement des maladies. Les MTI explorent ainsi de nouvelles approches thérapeutiques basées sur la modification du génome, la manipulation de cellules du patient ou de donneurs sains et d’autres méthodes novatrices, représentant ainsi une transition majeure de la médecine traditionnelle vers une médecine plus personnalisée et ciblée.
Classification et mécanismes
Un Médicament de Thérapie Innovante (MTI), ou Advanced Therapy Medicinal Product (ATMP) en anglais, est une catégorie de médicament qui se distingue par l’utilisation de technologies novatrices pour traiter des maladies graves. Ces thérapies exploitent des approches telles que la thérapie génique, la thérapie cellulaire, et d’autres méthodes de manipulation génétique pour cibler spécifiquement les causes moléculaires des maladies.
Les MTI se distinguent des médicaments thérapeutiques conventionnels en agissant notamment sur la cause moléculaire d’une maladie, plutôt que sur le traitement des symptômes. Ils offrent ainsi des solutions potentielles pour des maladies qui étaient auparavant considérées comme incurables.
Les premières applications de thérapies géniques ont été explorées dès les années 1980, mais le domaine a connu un essor significatif au cours des années 2000 avec l’amélioration des techniques de manipulation génétique et les avancées sur notre compréhension des cellules souches.
On peut discerner différentes grandes catégories de MTI, les principales étant les thérapies géniques et les thérapies cellulaires. Les MTI intègrent également l’ingénierie tissulaire ou encore des technologies combinant des produits issus de la manipulation de gènes, de cellules ou de tissus et des dispositifs médicaux.
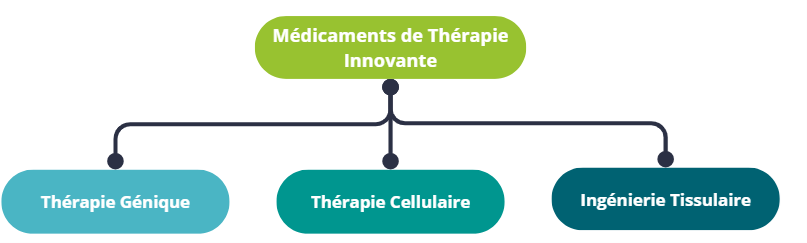
Classification des Médicaments de thérapie innovante (MTIs)
Les thérapies géniques
La thérapie génique vise à introduire, réparer ou remplacer des gènes dans les cellules du patient. Elle peut être utilisée pour traiter des maladies en modifiant le matériel génétique des cellules, offrant ainsi une approche ciblée pour corriger les anomalies génétiques à l’origine de diverses affections.
Il existe deux méthodes d’administration du matériel génétique en tant que médicament : ex-vivo ou in-vivo. La stratégie in-vivo prévoit une administration directe au patient, sans manipulation de cellules en dehors de l’organisme. Avec la thérapie génique ex-vivo, les cellules ciblées sont d’abord prélevées du patient (en autologue) ou d’un donneur sain (en allogénique) avant d’être modifiées génétiquement et réinjectées. Ces thérapies géniques ex-vivo sont généralement appelées thérapies cellulaires génétiquement modifiées.
Dans les deux cas le matériel génique est délivré dans la cellule à l’aide d’un vecteur. Il existe plusieurs types de vecteurs, parmi lesquels les virus modifiés sont les plus couramment utilisés. Ces vecteurs viraux sont généralement conçus en éliminant leur capacité à causer des maladies tout en conservant leur capacité à pénétrer les cellules. Certains types courants de vecteurs viraux comprennent les rétrovirus, les lentivirus, les adénovirus et les adéno-associés. Il existe également des vecteurs non viraux, qui peuvent inclure des lipides ou des polymères par exemple. Ils ont l’avantage de minimiser les risques liés à l’utilisation de virus et de pouvoir transporter plus de matériel génétique, mais ils peuvent être moins efficaces dans la pénétration cellulaire.
En termes d’applications cliniques, les thérapies géniques ont permis d’apporter des solutions dans diverses aires thérapeutiques y compris le traitement des cancers, de maladies musculaires ou encore ophtalmiques. Le premier médicament de thérapie génique a été approuvé en Chine en 2003 : de son nom commercial, Gendicine, cet adénovirus est indiqué dans le cancer de la tête et du cou. Plus récemment, le médicament Zolgensma a été le premier traitement de thérapie génique pour une maladie neuromusculaire ayant reçu une AMM en Europe, au Japon et aux USA. Il permet de traiter des cas d’amyotrophie spinale infantile.
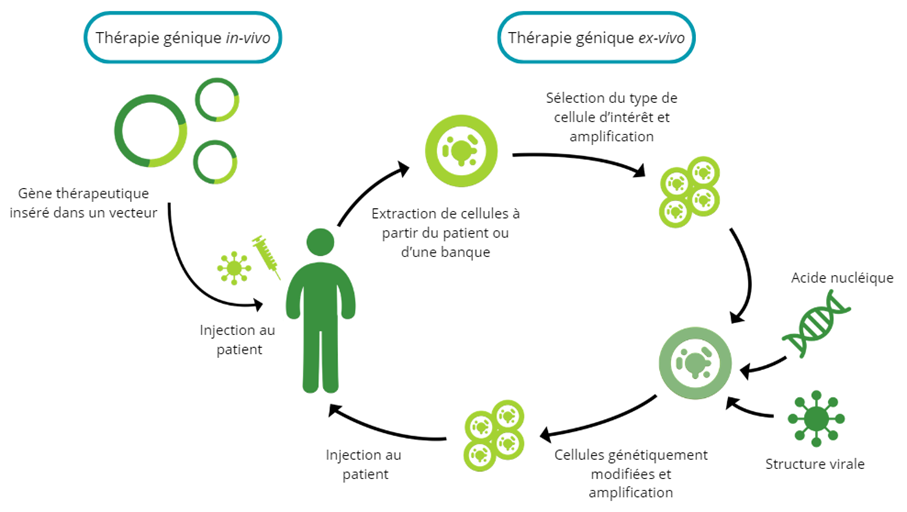
Mécanismes des thérapies géniques in-vivo et ex-vivo
Les thérapies cellulaires
La thérapie cellulaire consiste en la manipulation de cellules, souvent des cellules souches, pour régénérer ou remplacer des cellules endommagées. Le traitement diffère d’une greffe traditionnelle où les cellules ne sont pas significativement manipulées et pour lesquelles les cellules ont la même fonction essentielle que chez le donneur. On considère comme un médicament de thérapie cellulaire des cellules ou un tissu qui ont été manipulées ou reprogrammées avant l’administration au patient.
Les cellules souches pluripotentes peuvent produire n’importe quel type de cellule dans le corps humain. Elles sont également capables de se multiplier et d’être maintenues en dehors du corps humain pendant une longue période : elles représentent ainsi un outil idéal pour le développement de thérapies cellulaires.
La thérapie cellulaire peut également être réalisée avec des cellules souches multipotentes qui peuvent se différencier en un nombre plus restreint de types cellulaires que leurs homologues pluripotentes. Les cellules souches mésenchymateuses sont les plus utilisées, elles sont présentes dans tout l’organisme au sein du tissu adipeux, de la moelle osseuse, des tissus de soutien des organes, mais également au sein des os, des cartilages, des muscles, etc.
L’utilisation de cellules souches cutanées pour soigner les grands brûlés est pratiquée depuis les années 70. Les thérapies cellulaires approuvées se positionnent dans le traitement d’hémopathie malignes ou encore en ophtalmologie. Les essais cliniques sont variés, surtout pour les traitements avec des cellules souches mésenchymateuses, et concernent la rhumatologie (arthrose, polyarthrite rhumatoïde), les dégénérescences musculaires (myopathies), la cardiologie, le diabète, les maladies auto-immunes, etc.
Parmi les thérapies cellulaires on trouve également des cellules qui ne sont pas des cellules souches, incluant les cellules du système immunitaire comme les cellules dendritiques, les lymphocytes T cytotoxiques ; et aussi d’autres types cellulaires : kératinocytes, fibroblastes, myoblastes.
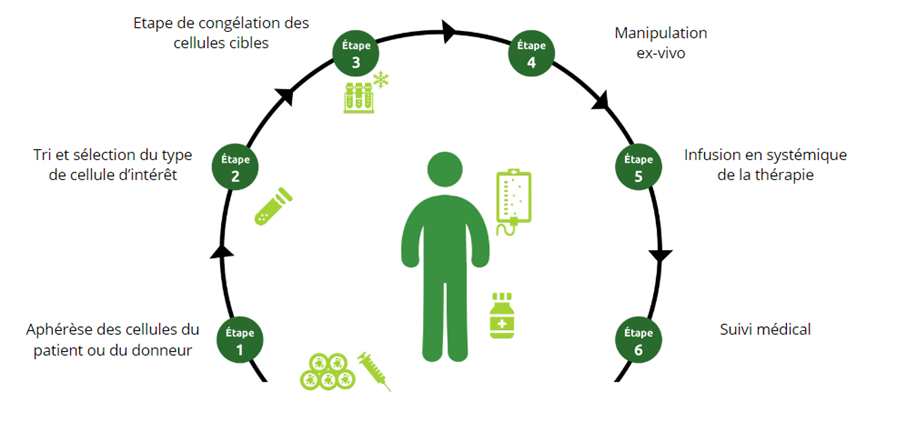
Mécanismes des thérapies cellulaires
Les produits issus de l’ingénierie tissulaire
Un produit d’ingénierie tissulaire contient des cellules ou tissus, soumis à une manipulation, possédant des propriétés permettant de régénérer, réparer ou remplacer un tissu humain. L’ingénierie tissulaire est issue de la bio-ingénierie, qui a pour objectif de développer des méthodes pour créer des tissus biologiques fonctionnels en laboratoire.
Les principales étapes de l’ingénierie tissulaire impliquent généralement la sélection ou la création de biomatériaux compatibles avec le corps, la culture de cellules spécifiques en laboratoire, l’assemblage de ces cellules en structures tridimensionnelles (appelées échafaudages ou matrices), et enfin, la transplantation de ces structures dans le corps du patient. Ces structures sont conçues pour imiter la structure et la fonction des tissus naturels, favorisant ainsi la régénération et l’intégration dans le tissu environnant. Les applications concernent majoritairement la réparation des lésions tissulaires chroniques, aigues, dégénératives ou traumatiques.
Réussites et défis futurs des MTI
Des thérapies ciblées et personnalisées
Les Médicaments de Thérapie Innovante représentent une avancée significative dans le domaine médical en raison de leur capacité à directement cibler les mécanismes biologiques responsables des pathologies. Cette capacité découle de la nature personnalisée des MTI, qui peuvent être conçus pour s’adapter aux caractéristiques génétiques et biologiques uniques de chaque patient. En comprenant précisément les mécanismes moléculaires responsables d’une maladie donnée chez un patient donné, les MTI peuvent être modulés pour corriger les anomalies génétiques, stimuler la régénération cellulaire ou encore réguler ou améliorer des processus biologiques spécifiques.
Cette approche ciblée présente plusieurs avantages, notamment une efficacité accrue du traitement et une réduction des effets secondaires indésirables associés à des interventions médicamenteuses moins précises (la chimiothérapie par exemple).
En agissant directement sur la cause fondamentale de la maladie, les MTI ouvrent la voie à des traitements plus puissants et adaptés, promettant ainsi une révolution dans la prise en charge de différentes maladies.
Défis et perspectives
Si les MTI ouvrent de nouvelles perspectives thérapeutiques, leur utilisation implique des défis notamment en matière de sécurité, de bioproduction (coûts, standardisation, etc.), d’administration, d’accès pour les patients et de réglementation.
La manipulation génétique et cellulaire associée aux MTI comporte des risques qu’il est crucial de comprendre, et de maîtriser.
Les MTI ont la capacité et la fonction de rester dans le corps humain, ils incluent du matériel vivant qui se développe et interagit avec les autres éléments constitutifs de l’organisme. Les réponses immunitaires inattendues, les mutations génétiques non prévues et d’autres réactions indésirables nécessitent une surveillance étroite pour évaluer la sécurité à long terme des MTI. Cette classe de médicament étant récente, nous manquons pour l’instant de recul les concernant, a fortiori étant donné leur variété et la complexité des processus techniques et biologiques sur lesquels ils reposent.
La complexité technique des MTI découle également de leur nature personnalisée. La standardisation des procédures techniques représente un défi majeur, nécessitant une expertise avancée pour assurer la reproductibilité et la qualité des MTI à grande échelle, sans compromettre la personnalisation qui fait leur force. D’autre part, certains types de MTI nécessitent des procédures complexes de manipulation et d’administration, ce qui peut poser des problèmes de logistiques et un besoin de formation du personnel médical.
Enfin, le coût élevé associé au développement des MTI constitue l’un des enjeux essentiels du secteur. La recherche et le développement de ces thérapies nécessitent des investissements considérables en ressources humaines et en infrastructures spécialisées. Les coûts de production des vecteurs viraux, des cellules modifiées et d’autres composants spécifiques aux MTI sont également substantiels. Ces coûts élevés se répercutent sur le coût final des traitements, soulevant des préoccupations quant à l’accessibilité économique pour un large éventail de patients.
Aperçu du marché des Médicaments de Thérapie Innovante (MTI)
MabDesign fait constamment évoluer son expertise sur différentes classes de biomédicaments, y compris concernant le marché des MTI et plus particulièrement les segments des thérapies géniques et des thérapies cellulaires.
Ces produits innovants accélèrent l’essor des biothérapies et représentent actuellement environ un tiers des biomédicaments en développement. Au total, environ 7000 MTI sont actuellement dans le pipeline de développement, regroupant des thérapies géniques (dont les thérapies cellulaires génétiquement modifiées, ou ex-vivo) et des thérapies cellulaires.
Sur le marché :
en développement :
Pipeline MTI
Les produits de thérapie génique sont largement investigués avec 5 075 produits en développement pour 28 ayant reçu une AMM. Les thérapies géniques ex-vivo représentent quasiment 60% des thérapies géniques en développement. Les cellules CAR-T sont les thérapies géniques ex-vivo ayant reçu le plus d’approbation de mise sur le marché. Le premier traitement par cellules CAR-T a été commercialisé par Novartis sous le nom commercial de Kymriah, approuvé par la FDA en 2017. Depuis, différentes thérapies par cellules CAR-T ont été approuvées et sont positionnées en hématologie, notamment pour le traitement de lymphomes ou de myélomes.
Les médicaments de thérapie cellulaire sont plus nombreux sur le marché : on dénombre actuellement 41 produits commercialisés. Très récemment, de nouvelles thérapies cellulaires, appelées TILS pour « Tumor Inflating Lymphocytes », ont été développées. Un premier produit, le Lifileucel de Iovance, a été approuvé par la FDA, destiné aux patients atteints de mélanome métastatique. Actuellement, 1 894 thérapies cellulaires sont en développement dont 731 utilisent des cellules souches. Parmi les aires thérapeutiques ciblées par les produits à base de cellules souches on distingue les maladies neurodégénératives en majorité, puis les maladies cardiovasculaires et les dégénérescences musculaires.
L’arrivé des Médicaments de Thérapie Innovante offre des solutions jugées révolutionnaires et prometteuses dans la prise en charge des patients, notamment via des traitements personnalisés, ciblant les causes sous-jacentes des maladies. Pour encourager le développement de ces MTI, des actions significatives ont déjà été mises en place et devront être maintenues : investir massivement dans la recherche et le développement via des financements publics ou privés, faire évoluer la réglementation pour garantir la sécurité tout en accélérant la mise sur le marché ou encore réduire les coûts de production pour permettre l’accès à un grand nombre de patients.
Si vous cherchez du soutien dans vos projets en lien avec la thérapie génique ou la thérapie cellulaire, n’hésitez pas à explorer notre offre de services, et à nous contacter pour échanger. Nous serons ravis de mettre à profit notre expertise pour vous aider à atteindre vos objectifs !
Mabdesign s’associe en 2024 avec la Société Française de Thérapie Cellulaire et Génique (SFTCG) pour organiser le premier congrès sur les Innovations en Thérapie Génique et Cellulaire. Cette journée permet aux experts du domaine, académiques et industriels, d’échanger sur les avancées récentes.
Sources
- Expertise MabDesign
- GlobalData Février 2024
- Société Française de Thérapie Cellulaire et Génique
- Thérapie cellulaire et Thérapie Génique, Inserm
- Les Médicaments de Thérapie Innovante, changement de paradigme dans les soins de santé, BioMérieux
- Les produits biologiques, ANSM
- La France et les médicaments de thérapie innovante, LEEM et MabDesign