Les vecteurs viraux sont des outils thérapeutiques essentiels pour les thérapies géniques ou certains vaccins. Ils permettent notamment de délivrer des gènes thérapeutiques ou des antigènes dans les cellules hôtes. La thérapie génique, classe innovante de produits biologiques, a ouvert de nouveaux horizons et permis de répondre à des besoins médicaux jusqu’alors non satisfaits, notamment en oncologie ou dans les maladies rares. Constatant l’arrivée croissante de produits de thérapie cellulaire et génique sur le marché, la FDA prévoyait, entre 2019 et 2025, d’approuver 10 à 20 nouveaux produits par an sur la base d’une évaluation du pipeline et des taux de réussite clinique de ces produits.
Dans ce contexte, la production des vecteurs viraux, qui constituent la modalité la plus répandue, est devenue un secteur stratégique stimulant innovation et développements pour répondre aux contraintes techniques, économiques ou logistiques du secteur. Nous fournissons ici un aperçu de l’état actuel des défis de la bioproduction des vecteurs viraux mais également des technologies innovantes émergentes pour permettre de répondre à la demande grandissante. Nous mettons en évidence les chiffres clés du marché de la bioproduction des vecteurs viraux ainsi que ses acteurs majeurs.
Enjeux de la bioproduction des vecteurs viraux
Les vecteurs viraux sont utilisés pour différentes applications, parmi lesquelles :
- la thérapie génique in vivo ciblant des troubles rares acquis ou héréditaires,
- l’ingénierie de cellules autologues/allogéniques pour des thérapies cellulaires ex vivo,
- les vaccins à vecteur recombinant,
- l’ingénierie des plantes et du microbiome intestinal des animaux.
Dans le domaine de la thérapie génique, les virus adéno-associés (AAV) sont le vecteur de choix en raison de leur tropisme tissulaire, de leur faible immunogénicité et génotoxicité, et de leur transduction efficace avec une expression génique soutenue. Les lentivirus fournissent une expression transgénique très stable, ce qui leur vaut leur utilisation pour la thérapie génique ex vivo, principalement pour produire des cellules CAR-T ou des cellules souches pluripotentes et hématopoïetiques. Les adénovirus sont devenus des agents oncolytiques et des vaccins pour leur rôle immunostimulateur inné et leur activité de réplication.
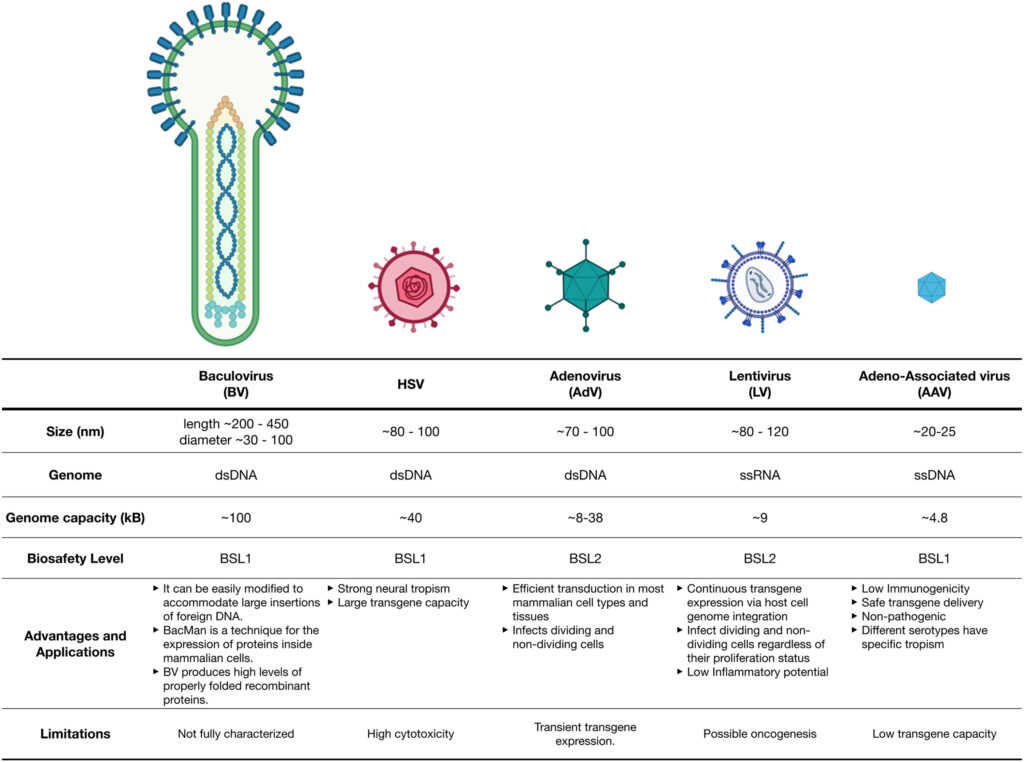
Figure 1 : hétérogénéité des vecteurs viraux : taille capacité génomique et principales applications. Source : R. Kilgore, 2023.
Le développement et la production des vecteurs viraux sont plus récents que ceux d’autres classes de biomédicaments, comme les anticorps monoclonaux : il n’existe pas actuellement de procédés universels et standardisés de fabrication. De plus, il existe des différences majeures entre ces deux types de molécules qui empêchent une transposition des méthodes : les vecteurs viraux sont des molécules plus grosses et plus complexes, nécessitant un niveau de contrôle et de biosécurité supérieur (BSL-2 pour la plupart des vecteurs viraux par rapport à une classification BSL-1 pour les mAbs), ce qui ajoute aux coûts de production et d’installations.
De la production à petite échelle à la production industrielle
Les acteurs utilisent donc différents systèmes de production upstream et processus downstream et se heurtent à différents défis. La montée en échelle est notamment une difficulté rencontrée par de nombreux laboratoires académiques qui développent des procédés de production à l’échelle du laboratoire, avec des cultures cellulaires adhérentes dans des flacons multicouches. Ces procédés, qui nécessitent des manipulations manuelles, rendent la mise à l’échelle difficile voir impraticable. Pour des raisons de temps et de coûts, les entreprises produisent encore souvent les premiers lots précoces en utilisant ces procédés « laboratoires ». Elles sont alors confrontées à des défis importants pour changer de procédés de production, permettant une fabrication en plus grande quantité et répondant aux exigences réglementaires en cas de réussite de ces essais de phase I.
La production des vecteurs viraux est précédée par la conception et la fabrication de plasmide. Les besoins en matière de plasmides sont grands et peuvent être une étape critique. Contrairement aux CHO, le gold-standard en matière de lignées cellulaires utilisées pour la production de mAbs, les cellules HEK293, utilisées pour la production des vecteurs viraux, présentent moins de clones stables. La plupart du temps, les productions de vecteurs viraux se font en transfection transitoire. C’est-à-dire que chaque fois qu’il y a une production de virus recombinant, il y a production de plusieurs plasmides nécessaires pour la transfection des cellules. Cela implique des tensions sur la fabrication des plasmides car la demande augmente et influence les coûts d’approvisionnement des plasmides.
Répondre aux besoins de conformités réglementaires strictes
Les enjeux liés aux exigences réglementaires et à la qualité dans la production des vecteurs viraux sont cruciaux, car ces produits sont destinés à des applications médicales sensibles, telles que les thérapies géniques et les vaccins. Les autorités de réglementation, comme la FDA (États-Unis) et l’EMA (Europe), imposent des normes strictes pour garantir la sécurité, l’efficacité, et la traçabilité des vecteurs utilisés dans des traitements cliniques.
Des méthodes analytiques pour maîtriser la qualité du produit tout au long du procédé sont donc développées dès la recherche et le développement du produit thérapeutique à l’échelle du laboratoire. Plusieurs attributs de contrôle qualité (CQA) sont couramment analysés comme la sécurité, l’identité, la fonctionnalité, la pureté ou encore la viabilité. Contrôler ces CQAs permet de démontrer que le produit final ne varie pas de manière significative d’un lot à l’autre.
Déterminer ces attributs critiques fait partie de l’approche Quality by Design (QbD) qui vise à intégrer la qualité du produit dès les étapes de développement. Le but est de s’assurer en amont que les sources de variabilité du procédé sont identifiées et prises en charge afin de garantir que le produit fini soit conforme aux caractéristiques prédéfinies. L’approche QbD n’est pas un requis réglementaire mais une approche d’assurance qualité, démarche fortement recommandée par les autorités de santé : toutes les nouvelles guidelines ICH, FDA ou EMA utilisent les notions et le vocabulaire QbD.
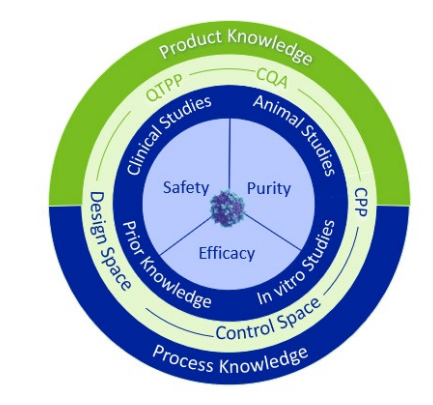
Figure 2 : Aperçu de la méthodologie utilisant la connaissance du processus et du produit pour développer l'approche QbD afin de servir la sécurité, la pureté et l'efficacité des produits pharmaceutiques AAV. QTPP : Profil de produit cible de qualité. AQC : Critical Quality Attributes, CPP : Critical Process Parameters (paramètres critiques du processus). Source : Cytiva.
Innovations dans la bioproduction des vecteurs viraux
Evolution des méthodes de culture
Les lignées cellulaires HEK293 habituellement utilisées pour la production de vecteurs viraux sont des cellules adhérentes. Pour pallier aux limites des méthodes de cultures cellulaires adhérentes traditionnelles, de nouvelles technologies ont été développées apportant des avantages considérables pour la production industrielle. Il s’agit notamment des méthodes de culture cellulaires en suspension, offrant des titres similaires à ceux de la culture adhérente et prenant en charge une densité cellulaire plus élevée. Les innovations sur les procédés de culture en suspension en bioréacteur ont permis d’arriver à des capacités de production de 1 000 à 2 000 L.
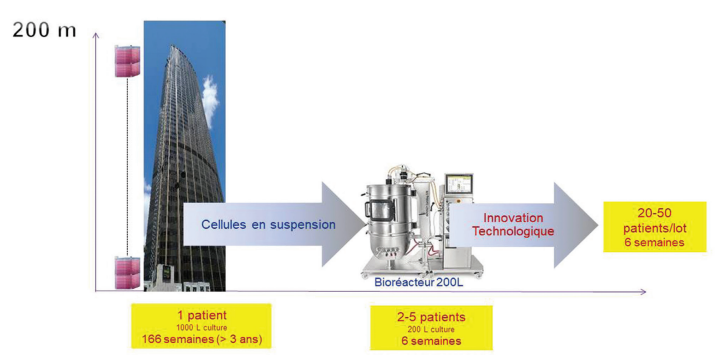
Figure 3 : Evolution des procédés de production de vecteurs viraux utilisant des bioréacteurs pour la production en suspension. Source : A Lamproye, 2023.
Technologies de purification
Le downstream des vecteurs viraux implique des contraintes notamment en lien avec la taille des molécules, la fragilité des virus et la présence d’un nombre important d’impuretés (ADN plasmidiques, protéines cellulaires, etc).
La chromatographie d’immunoaffinité (IAC) est actuellement la méthode la plus répandue pour la purification des vecteurs viraux. En effet, des activités de recherches dynamiques de la part d’académiques et d’industriels ont permis d’identifier des anticorps et fragments d’anticorps utilisés comme ligands d’affinité spécifiquement pour les vecteurs viraux. Une avancée majeure dans la technologie IAC a été réalisée avec le ligand AVB de Cytiva, basé sur un anticorps de camélidé à domaine unique (VHHs ou Nanobodies®). Cette technologie a stimulé le développement de ligands qui ont été conçus pour la purification des VV (POROS Capture Select de ThermoFisher ou CaptureSelect de Repligen)
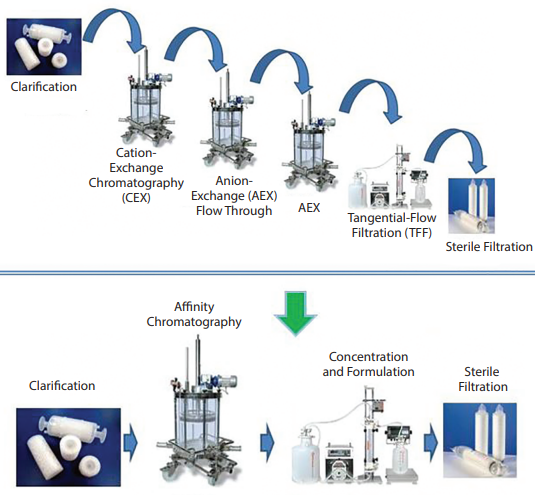
Figure 4 : Parallèle entre des techniques de downstream process standards (en haut) nécessitant plusieurs étapes de chromatographie, de filtration et de capture ; et des techniques innovantes (en bas) avec une seule étape de chromatographie par affinité. Source : O. Terova, 2016.
La chromatographie par échange d’ions (IEX) est la principale alternative à la chromatographie d’affinité pour l’étape de capture primaire et constitue la technologie prédominante utilisée pour le polissage des VV. L’IEX possède une puissante capacité à séparer les capsides vides des capsides pleines, ce qui constitue un avantage significatif par rapport à la chromatographie d’affinité. Cette séparation est importante car les capsides pleines sont les porteuses de matériel génétique thérapeutique dans les applications de thérapie génique, et des rapports plein/vide plus élevés peuvent augmenter l’efficacité du traitement.
Les récents succès de nouvelles méthodes comme la chromatographie d’exclusion stérique et des supports comme les monolithes et les membranes peuvent réduire les temps de traitement en tirant parti des propriétés de taille des vecteurs viraux. D’autres développements devraient être achevés sur la chromatographie continue, qui pourrait permettre une intensification du processus et une réduction des coûts, ce qui est important pour permettre l’accès à ces thérapies.
Le marché de la bioproduction des vecteurs viraux
Un marché en croissance
Au cours des dernières années, le nombre de thérapies par vecteurs viraux approuvées et en développement a augmenté, avec 10 produits ayant reçu une AMM et 1 229 produits en développement dans le pipeline actif. Ce nombre accru d’approbations et d’essais cliniques en cours liés à la thérapie génique à base de vecteurs viraux a entraîné une augmentation évidente de la demande de fabrication de vecteurs viraux à grande échelle.
Cette dynamique s’est donc répercutée sur le nombre d’investissements et de deals de la part des CDMO et des sociétés biotechs et pharmaceutiques, soit dans le but d’obtenir de nouvelles capacités de production, soit dans des acquisitions de capacités déjà existantes. En plus des CDMO et des sites de production in-house, des hôpitaux et centres universitaires se sont également dotés de capacités pour répondre aux besoins de production de phases I/II.
Loading..........
The Data is Not Available
Figure 5 : Thérapies géniques in vivo issues de vecteurs viraux approuvés. Source : GlobalData 2024, MabDesign.
Pipeline de thérapies géniques in vivo
Figure 6 : Produits de thérapie génique in vivo basés sur des vecteurs viraux en développement. Répartition par phases de développement. Source : GlobalData 2024, MabDesign.
Le paysage des acteurs CDMO s’est donc étoffé, et l’on dénombre en 2022 plus de 50 acteurs en Europe et aux USA. Le marché peut être défini comme concentré car 5 acteurs détiennent 40% de la capacité globale disponible : Catalent, FujiFilm Dyosinth, Lonza, Thermo Fisher Scientific et WuXi Advanced Therapies. Ces CDMO existaient depuis de nombreuses années et se sont souvent développées dans le domaine de la thérapie génique à la suite d’acquisitions, comme celle de l’entreprise américaine Brammer Bio par Thermo Fisher en 2019. Avec un CAGR estimé entre 10 et 20% entre 2024 et 2030, de nouvelles fusions ou acquisitions de sociétés dans un avenir proche/moyen terme sont à prévoir.

Figure 7 : CDMOs actives en production de vecteurs viraux (liste non exhaustive). Sources : adapted from A Lamproye 2023, MabDesign.
Evolution des modèles économiques dans la bioproduction
L’offre en bioproduction disponible pour les vecteurs viraux reste néanmoins un défi. La thérapie génique in vivo, où le produit final est le vecteur viral directement injecté au patient, utilise principalement le virus adéno-associé (AAV), ce qui rend ce vecteur particulièrement demandé. D’autre part, les capacités volumétriques ne répondent pas toujours au besoin : les tailles des lots nécessaires aux thérapies géniques in vivo sont de plus en plus élevées à mesure que leur application dépasse l’aire thérapeutique des maladies rares.
Des divergences stratégiques apparaissent, laissant la possibilité aux plus grandes entreprises, ayant suffisamment de ressources financières de se doter de capacités pour internaliser la production (ex. Cellectis). Cette option leur permet également de limiter le risque de pénurie d’approvisionnement et de conserver leur propriété intellectuelle. Les plus petites entreprises qui souhaitent commercialiser leur produit mais ne disposent pas d’assez de ressources pour investir dans des capacités de production se tourneront vers l’externalisation et devront parfois faire face à des délais d’attente importants. Néanmoins, la rapidité de mise sur le marché est essentielle pour les produits de thérapie géniques qui peuvent souvent bénéficier de désignations de procédure accélérée (ou statut de médicament orphelin par exemple) qui réduisent le temps de développement du médicament, ce qui crée encore plus de pression sur les CDMO.
Des structures alternatives offrent une réponse aux défis croissants de l’industrialisation des thérapies géniques, on parle par exemple de Shared Manufacturing Organization (SMO) ou d’installations modulaires de type « Plug-and-Play ». Le concept de SMO repose sur l’idée de mutualiser les capacités de production entre plusieurs acteurs. Plutôt que de construire des usines dédiées, les entreprises biopharmaceutiques, y compris les startups et les sociétés de biotechnologie, peuvent accéder à des installations partagées où la production est réalisée sur mesure pour différents clients. Les installations modulaires de type « plug-and-play » représentent une autre innovation clé dans la production des biomédicaments. Ces installations sont conçues pour être rapidement déployées, flexibles et modulaires, permettant aux entreprises de s’adapter aux besoins de production en un minimum de temps.
En septembre 2024, Sanofi a inauguré Modulus, une usine capable de s’adapter pour fabriquer jusqu’à 4 vaccins ou biomédicaments simultanément, et de se reconfigurer en quelques jours ou quelques semaines pour changer de plateforme technologique (vaccins viraux vivants atténués, à protéine recombinante ou encore à ARN messager, ainsi que des traitements issus de biotechnologies comme les enzymes ou les anticorps monoclonaux).
La société INITS a investi près de Montpellier pour créer l’usine nommée “INITS-SMO” (Shared Manufacturing Organization), qui a pour vocation de mettre à disposition des sociétés de biotechnologie des locaux répondant aux normes pharmaceutiques GMP, leur permettant ainsi de produire elles-mêmes leurs lots de candidats médicaments innovants pour les essais précliniques et cliniques.
Perspectives & Conclusion
Des approches comme l’intelligence artificielle (IA) ou l’industrie 4.0 peuvent offrir un potentiel de transformation intéressant pour répondre aux enjeux de production des vecteurs viraux précédemment mentionnés.
Des algorithmes basés sur l’IA pourraient notamment apporter un contrôle qualité plus prédictif, utilisant des modèles d’apprentissage automatique, appelés Machine learning, permettant de réduire les échecs de production. L’industrie 4.0, qui intègre directement l’IA dans son système global, permet de créer des jumeaux numériques apportant des simulations du procédé dans le but de l’optimiser. En 2023, Généthon et Thalès annoncaient une collaboration pour développer un modèle numérique qui permettra, grâce à l’Intelligence Artificielle, de modéliser les processus de bioproduction et d’en optimiser les rendements.
75% des thérapies géniques in vivo actuellement développées utilisent des vecteurs viraux, qui comprennent des rétrovirus, des lentivirus, des adénovirus et des virus adéno-associés. Grâce à leur grande infectiosité, les vecteurs viraux sont souvent très efficaces pour la transfection génique. Toutefois, leur sécurité clinique suscite des préoccupations en raison de leur tendance à provoquer des réponses immunitaires et à entraîner des mutations dues à l’insertion de transgènes. Des vecteurs non-viraux existent et sont de plus en plus développés à la suite de la crise du COVID19 et l’apparition des vaccins à ARNm. En particulier, les nanoparticules lipidiques (LNP) ou les polymères cationiques, qui ont démontré une capacité de chargement de gènes robuste, une sécurité et une praticabilité élevées. Ils présentent un potentiel intéressant pour la délivrance de gènes.
Avec les avancées technologiques et la compréhension croissante de la biologie virale, les perspectives de développement et d’innovation dans la production de vecteurs viraux promettent d’améliorer leur efficacité, leur sécurité et leur personnalisation, ouvrant ainsi la voie à des thérapies géniques et vaccins de plus en plus ciblés et accessibles pour un large éventail de maladies.

Cet article est un extrait de notre Bioprocess watch « USP and DSP for viral vectors » publiée en Novembre 2024. Vous pouvez la télécharger en intégralité sur le lien ci -dessous :
Bioprocess watch USP & DSP pour les vecteurs viraux
Nos autres watchs sont disponibles sur la page dédiée :
Si vous cherchez du soutien dans vos projets en lien avec les vecteurs viraux n’hésitez pas à explorer notre offre de services, et à nous contacter pour échanger.
Nous serons ravis de mettre à profit notre expertise pour vous aider à atteindre vos objectifs !
Sources
L’industrialisation des thérapies géniques : l’exemple d’Yposkesi, Réalités Industrielle, 2023
Strategies to adress the viral vetor manufacturing shortage, Cytiva
The downstream bioprocess toolbox for therapeutic viral vectors, R. Kilgore et al., 2023
Sous-traitance de la bioproduction des biomédicaments en France (MabDesign), La Vague, A3P
Roots Analysis
Markets and markets
GlobalData
Viral-vector therapies at scale: Today’s challenges and future opportunities, McKinsey & Company
Evaluation and Research on new policies to advance development of safe and effective cell and gene therapies, FDA